Rạng sáng ngày 29 tháng 12, NEJM đã công bố trực tuyến một nghiên cứu lâm sàng giai đoạn III mới về chủng virus corona mới của Trung Quốc VV116. Kết quả cho thấy VV116 không kém hơn Paxlovid (nematovir/ritonavir) về thời gian phục hồi lâm sàng và ít tác dụng phụ hơn.
Nguồn hình ảnh:NEJM
Thời gian phục hồi trung bình 4 ngày, tỷ lệ biến cố bất lợi 67,4%
VV116 là thuốc nucleoside uống chống virus corona mới (SARS-CoV-2) được phát triển với sự hợp tác của Junsit và Wang Shan Wang Shui, và là chất ức chế RdRp cùng với remdesivir của Gilead, molnupiravir của Merck Sharp & Dohme và azelvudine của Real Biologics.
Năm 2021, thử nghiệm lâm sàng giai đoạn II của VV116 đã hoàn thành tại Uzbekistan. Kết quả nghiên cứu cho thấy nhóm sử dụng VV116 có thể cải thiện tốt hơn các triệu chứng lâm sàng và giảm đáng kể nguy cơ tiến triển đến thể nặng và tử vong so với nhóm đối chứng. Dựa trên kết quả tích cực của thử nghiệm này, VV116 đã được phê duyệt tại Uzbekistan để điều trị cho bệnh nhân COVID-19 từ trung bình đến nặng, và trở thành thuốc điều trị mạch vành mới đầu tiên được phê duyệt lưu hành ở nước ngoài tại Trung Quốc [1].
Thử nghiệm lâm sàng giai đoạn III này[2] (NCT05341609), do Giáo sư Triệu Nhân của Bệnh viện Thụy Kim Thượng Hải, Giáo sư Cao Nguyên của Bệnh viện Nhân Tế Thượng Hải và Viện sĩ Ninh Quang của Bệnh viện Thụy Kim Thượng Hải dẫn đầu, đã được hoàn thành trong đợt bùng phát do biến thể Omicron (B.1.1.529) gây ra từ tháng 3 đến tháng 5 tại Thượng Hải, với mục đích đánh giá hiệu quả và tính an toàn của VV116 so với Paxlovid trong điều trị sớm cho bệnh nhân COVID-19 từ nhẹ đến trung bình. Mục đích là đánh giá hiệu quả và tính an toàn của VV116 so với Paxlovid trong điều trị sớm cho bệnh nhân COVID-19 từ nhẹ đến trung bình.
Nguồn hình ảnh: Tài liệu tham khảo 2
Một thử nghiệm đa trung tâm, mù đôi, ngẫu nhiên, có đối chứng, trên 822 bệnh nhân Covid-19 trưởng thành có nguy cơ tiến triển cao và có các triệu chứng từ nhẹ đến trung bình đã được tiến hành từ ngày 4 tháng 4 đến ngày 2 tháng 5 năm 2022 để đánh giá tính đủ điều kiện tham gia của những người tham gia từ bảy bệnh viện ở Thượng Hải, Trung Quốc. Cuối cùng, 771 người tham gia đã được dùng VV116 (384 người, 600 mg mỗi 12 giờ vào ngày 1 và 300 mg mỗi 12 giờ vào ngày 2-5) hoặc Paxovid (387 người, 300 mg nimatuvir + 100 mg ritonavir mỗi 12 giờ trong 5 ngày) dưới dạng thuốc uống.
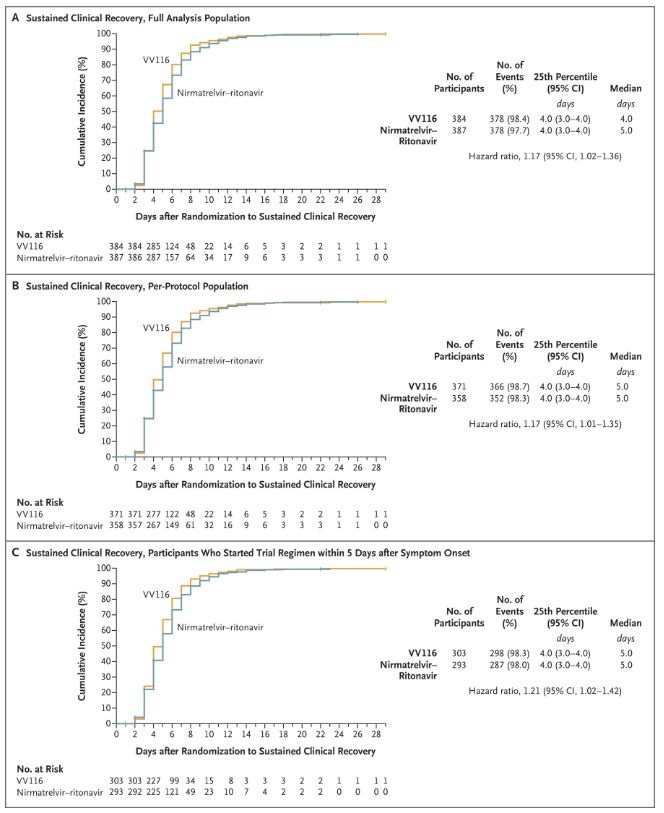
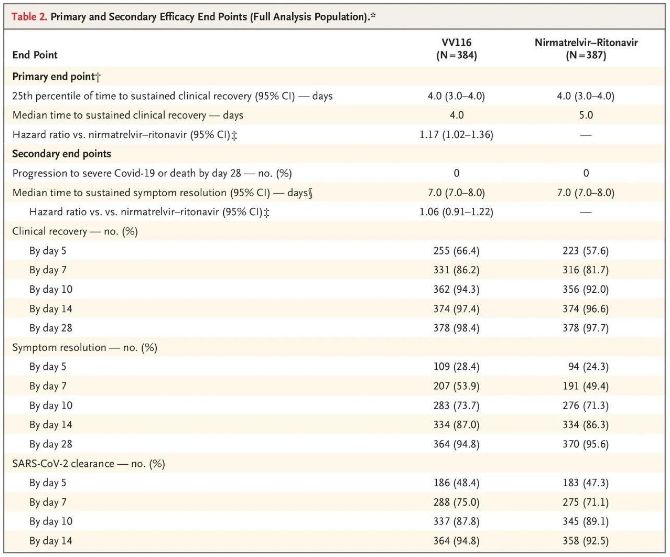
Kết quả của nghiên cứu lâm sàng này cho thấy việc điều trị sớm bằng VV116 cho bệnh nhân COVID-19 từ nhẹ đến trung bình đã đáp ứng được mục tiêu chính (thời gian phục hồi lâm sàng bền vững) theo dự đoán của phác đồ lâm sàng: thời gian trung bình để phục hồi lâm sàng là 4 ngày ở nhóm VV116 và 5 ngày ở nhóm Paxlovid (tỷ lệ nguy cơ, 1,17; 95% CI, 1,02 đến 1,36; giới hạn dưới. >0,8).
Duy trì thời gian phục hồi lâm sàng
Điểm cuối về hiệu quả chính và phụ (phân tích toàn diện dân số)
Nguồn hình ảnh: Tài liệu tham khảo 2
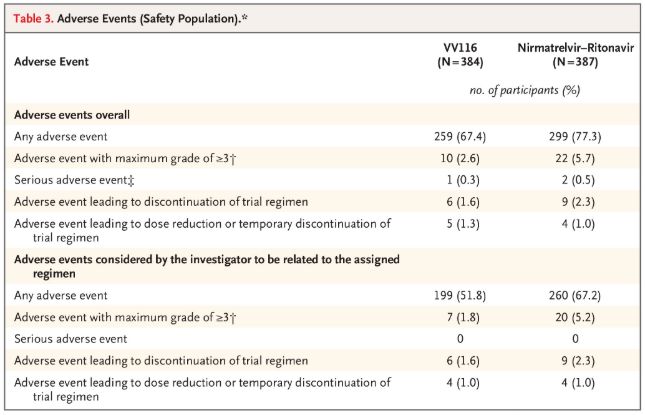
Về mặt an toàn, những người tham gia dùng VV116 báo cáo ít tác dụng phụ hơn (67,4%) so với những người dùng Paxlovid (77,3%) sau 28 ngày theo dõi và tỷ lệ tác dụng phụ cấp độ 3/4 thấp hơn ở VV116 (2,6%) so với Paxlovid (5,7%).
Sự kiện bất lợi (người an toàn)
Nguồn hình ảnh: Tài liệu tham khảo 2
Những tranh cãi và câu hỏi
Vào ngày 23 tháng 5 năm 2022, Juniper tiết lộ rằng nghiên cứu lâm sàng đăng ký Giai đoạn III của VV116 so với PAXLOVID để điều trị sớm bệnh COVID-19 từ nhẹ đến trung bình (NCT05341609) đã đạt được mục tiêu nghiên cứu chính của mình.
Nguồn hình ảnh: Tài liệu tham khảo 1
Vào thời điểm các chi tiết của thử nghiệm còn thiếu, tranh cãi xung quanh nghiên cứu Giai đoạn III đã tăng gấp đôi: thứ nhất, đây là một nghiên cứu mù đơn và do không có đối chứng giả dược nên người ta lo ngại rằng sẽ khó có thể đánh giá thuốc một cách hoàn toàn khách quan; thứ hai, có những câu hỏi về các điểm cuối lâm sàng.
Tiêu chuẩn lựa chọn lâm sàng cho Juniper là (i) kết quả xét nghiệm vương miện mới dương tính, (ii) một hoặc nhiều triệu chứng COVID-19 nhẹ hoặc trung bình, và (iii) bệnh nhân có nguy cơ cao mắc COVID-19 nặng, bao gồm tử vong. Tuy nhiên, tiêu chí lâm sàng chính duy nhất là "thời gian phục hồi lâm sàng bền vững".
Ngay trước thông báo, vào ngày 14 tháng 5, Juniper đã sửa đổi các điểm cuối lâm sàng bằng cách loại bỏ một trong những điểm cuối lâm sàng chính, “tỷ lệ chuyển sang bệnh nặng hoặc tử vong” [3].
Nguồn hình ảnh: Tài liệu tham khảo 1
Hai điểm tranh luận chính này cũng được đề cập cụ thể trong nghiên cứu đã công bố.
Do sự bùng phát đột ngột của Omicron, việc sản xuất viên giả dược cho Paxlovid chưa được hoàn tất trước khi thử nghiệm bắt đầu, do đó các nhà nghiên cứu không thể tiến hành thử nghiệm này bằng thiết kế mù đôi, mô phỏng kép. Về khía cạnh mù đơn của thử nghiệm lâm sàng, Juniper cho biết giao thức được thực hiện sau khi trao đổi với các cơ quan quản lý và thiết kế mù đơn đồng nghĩa với việc cả nhà nghiên cứu (bao gồm cả người đánh giá điểm cuối của nghiên cứu) lẫn nhà tài trợ đều sẽ không biết được phân bổ thuốc điều trị cụ thể cho đến khi cơ sở dữ liệu cuối cùng được khóa vào cuối nghiên cứu.
Cho đến thời điểm phân tích cuối cùng, không có người tham gia nào trong thử nghiệm tử vong hoặc tiến triển thành biến cố Covid-19 nghiêm trọng, vì vậy không thể rút ra kết luận nào về hiệu quả của VV116 trong việc ngăn ngừa tiến triển thành Covid-19 nghiêm trọng hoặc nguy kịch hoặc tử vong. Dữ liệu chỉ ra rằng thời gian trung bình ước tính từ khi phân nhóm ngẫu nhiên đến khi các triệu chứng mục tiêu liên quan đến Covid-19 giảm dần liên tục là 7 ngày (95% CI, 7 đến 8) ở cả hai nhóm (tỷ lệ nguy cơ, 1,06; 95% CI, 0,91 đến 1,22) [2]. Không khó để giải thích tại sao điểm cuối chính là 'tỷ lệ chuyển thành bệnh nặng hoặc tử vong', ban đầu được đặt ra trước khi kết thúc thử nghiệm, đã bị loại bỏ.
Vào ngày 18 tháng 5 năm 2022, tạp chí Emerging Microbes & Infections đã công bố kết quả thử nghiệm lâm sàng đầu tiên của VV116 ở những bệnh nhân bị nhiễm biến thể Omicron [4], một nghiên cứu đoàn hệ mở, có triển vọng với 136 bệnh nhân nội trú được xác nhận.
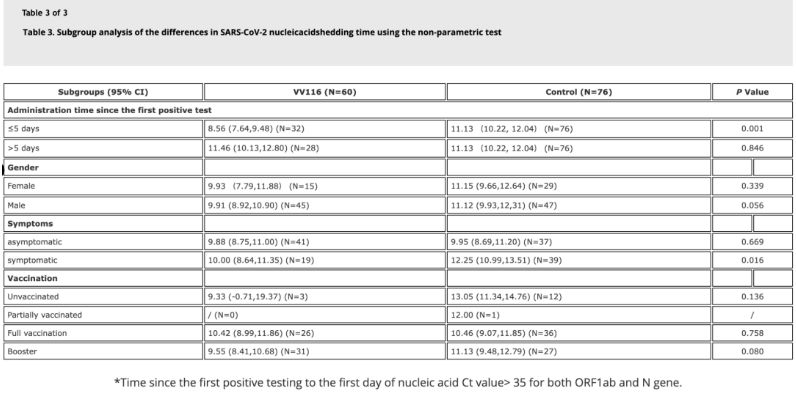
Dữ liệu từ nghiên cứu cho thấy những bệnh nhân nhiễm Omicron sử dụng VV116 trong vòng 5 ngày kể từ lần xét nghiệm axit nucleic dương tính đầu tiên có thời gian hồi phục axit nucleic là 8,56 ngày, thấp hơn so với 11,13 ngày ở nhóm đối chứng. Việc sử dụng VV116 cho những bệnh nhân có triệu chứng trong khoảng thời gian của nghiên cứu này (2-10 ngày kể từ lần xét nghiệm axit nucleic dương tính đầu tiên) đã rút ngắn thời gian hồi phục axit nucleic ở tất cả các bệnh nhân. Về mặt an toàn thuốc, không có tác dụng phụ nghiêm trọng nào được ghi nhận ở nhóm điều trị VV116.
Nguồn hình ảnh: Tài liệu tham khảo 4
Có ba thử nghiệm lâm sàng đang được tiến hành trên VV116, hai trong số đó là nghiên cứu giai đoạn III trên bệnh nhân COVID-19 từ nhẹ đến trung bình (NCT05242042, NCT05582629). Thử nghiệm còn lại trên bệnh nhân COVID-19 từ trung bình đến nặng là một nghiên cứu lâm sàng giai đoạn III đa trung tâm, ngẫu nhiên, mù đôi quốc tế (NCT05279235) nhằm đánh giá hiệu quả và độ an toàn của VV116 so với điều trị tiêu chuẩn. Theo thông báo của Juniper, bệnh nhân đầu tiên đã được ghi danh và dùng thuốc vào tháng 3 năm 2022.
Nguồn hình ảnh:clinicaltrials.gov
Tài liệu tham khảo:
[1]Junshi Biotech: Thông báo về điểm cuối chính của nghiên cứu lâm sàng đã đăng ký Giai đoạn III về VV116 so với PAXLOVID để điều trị sớm COVID-19 từ nhẹ đến trung bình
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Hồ sơ nhiễm trùng Omicron và tình trạng tiêm chủng ở 1881 người được ghép gan: một đoàn hệ hồi cứu đa trung tâm. Vi khuẩn & Nhiễm trùng mới nổi 11:1, trang 2636-2644.
Thời gian đăng: 06-01-2023
 中文网站
中文网站